Химические соединения состоящие из называются. Химия органическая. классы соединений. Химические и физические процессы в строительстве
ХИМИЯ ОРГАНИЧЕСКАЯ. КЛАССЫ СОЕДИНЕНИЙ
Органические соединения (углеводороды и их производные) можно разделить на два типа: ациклические (или алифатические, т.е. с открытой углеродной цепью) и циклические; последние в свою очередь подразделяются на алициклические, в молекулах которых содержатся углеродные кольца неароматического характера; ароматические, проявляющие свойства, характерные для бензола; гетероциклические, в которых один или несколько атомов в кольце представляют собой атомы неметаллов, отличные от углерода. Внутри каждого из этих типов возможна дальнейшая дифференциация на классы по присутствующим в них реакционным центрам - функциональным группам. Например, органические соединения, имеющие карбоксильную группу -СООН, являются кислотами и вступают в реакции, характерные для кислот (нейтрализация оснований, образование эфиров со спиртами и т.д.). Реакции таких групп несколько изменяются при изменении структуры молекулы, в которой они находятся; на них могут влиять и другие группы в молекуле, хотя это влияние обычно мало. Ниже перечислены типичные функциональные группы с примерами наиболее значимых и интересных представителей каждого класса, затем рассматриваются реакции функциональных групп (разд. IV. "Реакции органических соединений").
А. УГЛЕВОДОРОДЫ
Углеводороды являются соединениями углерода и водорода. (Простейший углеводород - метан СН4.) Алифатические и алициклические углеводороды могут содержать прямые (неразветвленные), разветвленные или замкнутые в кольца цепи углеродных атомов. Если четыре углеродных атома соединены один с другим только простыми (одинарными) связями, образуется углеводород бутан C4H10 с открытой (неразветвленной) цепью:
Атомы атомов обычно не очень привлекательны для электронов, а наоборот, они стараются как можно больше избавиться от них. Подобно солям, металлы могут перерасти в кристаллы, потому что их атомы располагаются в решетке. Они отталкивают все свои внешние электроны. Создаются свободные электроны, которые не могут быть назначены точно определенному атому.
От чего и как зависят скорость химической реакции и степень превращения исходных веществ в продукты?
Из-за свободной подвижности электрона возникают типичные свойства металлов.
- Они могут хорошо проводить электричество и тепло.
- Они сияют и могут размышлять.
Здесь черточки изображают ковалентные связи между углеродными атомами в плоскости страницы, пунктирные линии - связи с атомами водорода ниже, а жирные клинообразные линии - с атомами водорода выше этой плоскости. Углы между углерод-углеродными связями 109°. Эта молекула может свободно вращаться вокруг простых связей (что вообще справедливо для простых связей).
Структурную формулу бутана можно написать как
Эти соединения имеют химическую формулу: фтористоводородная кислота, чтобы назвать случай, представляет собой соединение, образованное атомом водорода и атомом фтора. В этой же области мы можем установить, что существует широкая классификация вышеупомянутых химических соединений, среди которых следующие.
Как следует из названия, это результат смеси водорода и другого элемента вышеупомянутой периодической таблицы. Они также характеризуются тем, что они могут быть как металлическими, так и неметаллическими. Кислород является фундаментальной основой его образования, что также требует наличия металла.

либо проще, CH3-CH2-CH2-CH3 или CH3CH2CH2CH3. Для четырех углеродных атомов, связанных простыми связями, возможна также структура с разветвленной цепью:

Эта формула изображает другое соединение - изобутан, у которого иные свойства, чем у бутана (например, более низкие температуры кипения и замерзания). Заметим, что и бутан, и изобутан имеют один и тот же состав: C4H10. Такие соединения, с одинаковыми брутто-формулами, называются "изомерами". Изомерия - обычное явление в органической химии, для сложных формул возможны миллиарды изомеров. Существуют два циклических четырехуглеродных (C4) углеводорода, содержащих только простые связи: циклобутан и метилциклопропан, оба имеют брутто-формулу C4H8:
Хлорид натрия, то есть так называемая поваренная соль, является одним из прекрасных примеров такого химического соединения, которое является результатом добавления гидроцида и гидроксида. Кислотные оксиды, оксисолы или оксокислоты - это другие типы соединений, которые являются частью этой науки, к которой мы сейчас обращаемся.
Хотя вышеупомянутое фиксированное отношение является неотъемлемым свойством соединений, связи между соединениями смеси нестабильны. С другой стороны, элементы соединения могут быть разделены только химическими процессами; С другой стороны, элементы смеси можно разделить на физические механизмы, такие как дистилляция или декантация. В области, соединение - это слово, которое создается по составу, по крайней мере, двух простых терминов: «Пожалуйста, передайте мне штопор» - это фраза, где «штопор» представляет собой сложное слово.

Насыщенные и ненасыщенные углеводороды.
Насыщенные (предельные) углеводороды - алканы (парафины) - содержат только простые (одинарные) связи между атомами углерода (например, метан, бутан, изобутан и циклобутан). Если в молекуле присутствует кратная (двойная, тройная) связь, соединение называют ненасыщенным (или непредельным) - это алкены (олефины) и алкины (ацетилены). Алканы обычно химически инертны, поскольку все валентные электроны углерода и водорода прочно связаны в сильных ковалентных связях. Метан, бутан и изобутан представляют собой алканы. Циклоалканы, представителями которых являются циклобутан и метилциклопропан, - алканы, содержащие кольцо из углеродных атомов. У ненасыщенных углеводородов реакционный центр находится по месту кратной связи. Они вступают в разнообразные химические реакции гораздо легче, чем насыщенные углеводороды. Простейший из алкенов - этилен:
Каков механизм химической реакции?
В дополнение ко всему вышесказанному, мы можем констатировать, что существует большое количество выражений или терминов, которые используют используемое нами понятие. Так, например, это будет известно как композитная вода, которая представляет собой напиток из сахара, воды и сока различных фруктов. Это было бы в случае с лимонной водой.
В области искусства, с другой стороны, мы находим термин «состав капитала», который характеризуется тем, что он является результатом объединения нескольких стилей. В частности, любая столица этого типа определяется наличием листьев аканта, характерных для коринфских, а также свитков, характерных для ионического.

Все атомы этой молекулы лежат в одной плоскости. Вращение вокруг двойных связей невозможно, поэтому если два олефина одинакового состава различаются расположением групп относительно двойной связи, то они не идентичны и называются цис-транс-изомерами. У цис-изомеров одинаковые группы, соседние с двойной связью, расположены по одну сторону двойной связи, тогда как в транс-изомерах - по разные стороны.
Для ботаники, наконец, композитные растения - это те, которые отличаются своими простыми листьями и их цветами, сгруппированными вместе с общим сосудом, таким как артишок. В понедельник студенты седьмого класса имели возможность жить. Настоящий праздник химии.
Лаборатория, в которой студенты из Шуменского университета продемонстрировали часть. Секреты этой сложной, но всепроникающей науки. «Волшебники». Цветные красные цветы, с которыми химики «объясняют себя в любви». Искривленная жидкость стеклянным стержнем, продемонстрировала, как были произведены реакция «золотого дождя» и «зубная паста для слонов». И ребята представили на электронной доске интересные факты о воде - наиболее общем химическом составе. В викторине участники показали, что они уже сделали первые успешные шаги по освоению химических знаний.

Ацетилен H-CєC-H является простейшим алкином. Все его атомы лежат на прямой линии, поэтому цис-транс-изомерия невозможна, хотя атомы, связанные тройной связью, не могут вращаться друг относительно друга. Молекула бутина-2 H3C-CєC-CH3 также линейна. Ароматические углеводороды содержат шестичленные кольца условно с тремя двойными связями, чередующимися с тремя простыми. Простейшим соединением этого типа является бензол, имеющий структуру
И наиболее активно участвовали в организации праздника - авторы эссе и рисунки «Химия - наша жизнь, наше будущее» - получили свои награды. Рисунок: Первое место - Валерия Пейчева, второе место - Анна Томова, третье место - Геновева Маринова. Директор школы г-жа Тодорова поприветствовала всех участников и купила их с конфетами, потому что они уже правильно ответили на викторину, что сахар не опасен для организма.
Праздник был организован в связи с Международным годом химии, но мы надеемся, что это станет традицией. Химия - наша жизнь, наше будущее. Будем ли мы когда-либо существовать и быть окружены всеми этими вещами, которые мы видим, используем и обладаем? Без химии все это было бы невозможно! Все вокруг состоит из атомов химических элементов и молекул химических соединений. Даже планета Земля напоминает огромный атом, чье ядро является ядром Земли вместе с ее мантией; электронный конверт - все, что нас окружает; а электроны - миллиарды жителей нашей планеты.

Свойства.
Углеводороды представляют собой наименее полярные из органических молекул, поскольку связи C-H почти полностью ковалентны. В результате они имеют относительно низкие температуры кипения (т. кип.) и плавления (т. пл.) по сравнению с другими органическими соединениями. Углеводороды, содержащие в цепи до четырех атомов углерода включительно, при атмосферном давлении и комнатной температуре газообразны; к ним относятся топливные газы метан CH4, этан C2H6, пропан C3H8 и бутан C4H10 (последние два обычно продают в баллонах под давлением). Насыщенные неразветвленные углеводороды становятся твердыми при комнатной температуре, начиная с углеводорода C16. Разветвленные и ненасыщенные углеводороды являются более низкоплавкими соединениями; например, углеводород с прямой цепью гексадекан CH3(CH2)14CH3, или C16H34, плавится при 20° С, а разветвленный углеводород тетрамер 2-метилпропена (C4H8)4, или C16H32, затвердевает при -139° С, тогда как ненасыщенный углеводород гексадецин-2 CH3(CH2)12CєCCH3, или C16H30, имеет т. пл. -25° С. Циклическим соединениям свойственны более высокие температуры плавления, чем алифатическим (с открытой углеродной цепью) соединениям той же молекулярной массы; например, у 1,3-диметилциклогексана C6H10(CH3)2 т. пл. -85° С, т.е. на 19° С выше, чем у неразветвленного углеводорода октена C8H16, который имеет ту же брутто-формулу (и поэтому ту же молекулярную массу), но плавится при -104° С. Все углеводороды горят, образуя углекислый газ и воду. Химические реакции насыщенных, ненасыщенных и ароматических соединений совершенно отличны друг от друга.
Практически важные углеводороды.
Ниже перечислены некоторые имеющие большое практическое значение углеводороды, их свойства и применения. Метан CH4 - бесцветный, не имеющий запаха газ с т. кип. -162° С. Он является главным компонентом природного газа, широко используемого как топливо. Сырая нефть - сложная смесь углеводородов (и некоторых следовых соединений) вплоть до С40. Перегонка и химическая переработка нефти дают множество промышленных углеводородов и очищенных смесей углеводородов. К продуктам, получаемым перегонкой нефти, относятся (в порядке повышения т. кип.) разбавители для красок, бензин, керосин, минеральные масла, смазочные масла и асфальт
(см.
НЕФТЕХИМИЧЕСКИЕ ПРОДУКТЫ ;
ХИМИЯ И МЕТОДЫ ПЕРЕРАБОТКИ НЕФТИ). Циклопропан - бесцветный горючий газ с т. кип. -33° С. Его используют в органическом синтезе и медицине (как анестетик). Этилен H2C=CH2, бесцветный газ с т. кип. -102° С. Исходный материал для синтеза ряда химических продуктов, в том числе этилового спирта и полиэтилена (см. ПЛАСТМАССЫ). Пропилен H3C-CH=CH2, бесцветный газ с т. кип. -48° С. Мономер полипропилена.
Бутадиен и стирол.
Бутадиен H2C=CH-CH=CH2, бесцветный горючий газ без запаха с т. кип. -4,5° С. Стирол C6H5CH=CH2, бесцветная жидкость со специфическим запахом ароматических соединений, т. кип. 146° С. Эти углеводороды служат исходными мономерами для получения ряда пластмасс и каучуков. Бензол C6H6, прозрачная, бесцветная, горючая жидкость с характерным запахом, т. кип. 80° С. Бензол широко используется как растворитель и исходный материал для синтеза многих органических соединений, включая взрывчатые вещества, красители и медицинские препараты. Нафталин C10H8 с молекулярной структурой в виде двух конденсированных колец (см. табл. 4). Это белые кристаллические пластинки с т. пл. 80° С, вещество летуче. Общеизвестно его применение в виде шариков для отпугивания моли; сырье в производстве красителей. Ацетилен HCєCH, бесцветный газ с т. кип. -83° С. Его применяют как горючее в ацетиленовых горелках для резки и сварки металлов, а также для синтеза многих других органических соединений.
Б. ОРГАНИЧЕСКИЕ ГАЛОГЕНИДЫ
Органические галогениды имеют общую формулу R-X, где R - стандартное обозначение для углеводородных групп, а X - атом галогена (фтора, хлора, брома или иода). Органические галогениды очень важны как исходные реагенты органического синтеза и растворители. Так же, как и углеводороды, они не очень полярны, и многие из них являются жидкостями. Некоторые из них ядовиты (например, тетрахлорид углерода), другие совершенно нетоксичны (например, фреоны, используемые в холодильниках для хранения пищевых продуктов). Хлориды гораздо дешевле бромидов и иодидов и потому находят более широкое применение в качестве растворителей. Практически важные органические галогениды. Тетрахлорид углерода CCl4, бесцветная негорючая жидкость, т. кип. 77° С. Его широко используют в качестве растворителя жиров и для выведения пятен, но он довольно ядовит и вдыхание заметных количеств его паров вызывает серьезное повреждение печени. Раньше его применяли для пожаротушения, но от этого пришлось отказаться, так как при высоких температурах из него может образоваться смертельно опасный газ фосген COCl2. Хлороформ (трихлорметан) CHCl3, жидкость со сладковатым запахом, т. кип. 61° С. Его широко применяли как анестетик, но поскольку он ядовит, были разработаны заменяющие его анестезирующие средства. Однако его еще используют для гуманного умерщвления животных. Как и тетрахлорид углерода, хлороформ является прекрасным растворителем. Трихлорэтилен ClCH=CCl2, стабильная, тяжелая, ядовитая жидкость, т. кип. 87° С. Широко применяется как растворитель для химической чистки наряду с другими сходными хлорсодержащими растворителями; все они дешевы, не слишком летучи и менее токсичны, чем тетрахлорид углерода. Дихлордифторметан CCl2F2, бесцветный инертный газ без запаха, т. кип. -30° С. Один из низкомолекулярных хлорфторуглеводородов, называемых фреонами или хладонами, которые использовались как хладагенты и пропелленты в аэрозолях для распыления красок, инсектицидов и т.д. К фреонам относятся также хлордифторметан и хлортрифторметан. Все фреоны нетоксичны и не вызывают коррозии, но в настоящее время международные экологические соглашения предусматривают постепенную замену их другими соединениями с аналогичными физическими свойствами, поскольку фреоны, попадая в стратосферу, способствуют разрушению защитного озонового слоя Земли. См. также ХОЛОДИЛЬНАЯ ТЕХНИКА . Тетрафторэтилен F2C=CF2, бесцветный газ с т. кип. -78,4° С, который полимеризуется, образуя тефлон, химически инертный полимер со структурой F(CF2)nF. Хлоропрен H2C=CCl-CH=CH2, бесцветная жидкость, т. кип. 59,4° С. Его используют преимущественно для производства хлоропренового (неопренового) каучука.
См. также КАУЧУК И РЕЗИНА . Винилхлорид H2C=CHCl, легко ожижаемый газ, т. кип. -13,9° С. Его применяют как хладагент и в производстве пластмасс. Метилбромид (бромметан) CH3Br, ядовитый газ, т. кип. 5° С. Используется для стерилизации почвы, так как в высоких концентрациях убивает все живые организмы; он безвреден для человека в низких концентрациях при кратковременном контакте.
В. СПИРТЫ
Спирты имеют общую структурную формулу ROH. Группа -OH высокополярна, и поэтому спирты гораздо более растворимы в воде и других полярных растворителях, чем углеводороды, галогениды или простые эфиры. Простые спирты, содержащие менее четырех атомов углерода, смешиваются с водой во всех соотношениях. Благодаря полярному характеру спиртов, их точки кипения также относительно высоки. Так, пропан C3H8, метилхлорид CH3Cl и этиловый спирт C2H5OH имеют приблизительно одинаковые молекулярные массы, но их т. кип. лежат соответственно при -24° С, -42° С и +78° С. Первые два соединения почти полностью нерастворимы в воде, тогда как этиловый спирт смешивается с ней в любых пропорциях. Спирты вступают в многочисленные и разнообразные реакции и поэтому имеют большое значение в качестве промежуточных соединений в синтезах. Они также являются важными промышленными растворителями.
Практически важные спирты.
Метиловый спирт (метанол) CH3OH, бесцветная растворимая в воде жидкость, т. кип. 65° С. Когда-то его получали сухой перегонкой дерева и потому его иногда называют "древесный спирт". Теперь его производят в наибольших количествах из нефти. Метиловый спирт - это смертельный яд, и его потребление внутрь может привести к слепоте или смерти. Он представляет собой важный растворитель для полярных соединений и используется в больших количествах как антифриз. Для последней цели его летучесть является серьезным недостатком, так как требует долива по мере испарения. Этиловый спирт (этанол) C2H5OH, бесцветная жидкость, т. кип. 78° С, полностью растворима в воде. Именно этиловый спирт содержится в спиртных напитках и приготавливается для этой цели сбраживанием крахмала, сахара или зерна. Он также находит широкое применение как промышленный растворитель и для приготовления настоек, которые являются просто растворами в спирте. Большие количества этилового спирта получают из этилена (продукта нефтяной промышленности). Этиловый спирт служит исходным материалом для приготовления длинного списка продуктов химической промышленности: уксусной кислоты, сложных эфиров и многих других низкомолекулярных соединений. Пищевой спирт идет на изготовление алкогольных напитков, но технический этиловый спирт выпускается также в виде т.н. денатурата, непригодного для питья, но подходящего для многих других целей. Денатурирование достигается прибавлением нескольких процентов постороннего трудно удаляемого вещества. Поступающий в продажу этиловый спирт содержит около пяти процентов воды, которую нельзя удалить простой перегонкой водно-спиртовой смеси. От последних следов воды можно избавиться перегонкой с небольшим количеством бензола или другими способами, дающими безводный "абсолютный" спирт. Изопропиловый спирт (изопропанол) (CH3)2CH-OH, бесцветная жидкость, т. кип. 82° С. Изопропиловый спирт используется как растворитель и как промежуточное вещество для получения сложных эфиров и других продуктов химической промышленности. Бутиловый спирт (бутанол) CH3CH2CH2CH2OH, бесцветная, частично растворимая в воде жидкость, т. кип. 118° С. В промышленности его получают сбраживанием крахмала (зерна) или сахаров при помощи особого штамма микроорганизмов, которые продуцируют бутиловый спирт и ацетон, а не этиловый спирт. н-Бутанол (нормальный бутиловый спирт, т.е. с неразветвленной углеродной цепью) находит широкое применение в производстве растворителей для лаков. Сивушное масло является смесью C5-спиртов, образующихся в качестве побочного продукта при получении других спиртов посредством брожения. Более обычный способ получения C5-спиртов, используемых в качестве растворителей и для приготовления эфиров, состоит в гидролизе C5-хлоридов, продуктов хлорирования соответствующей нефтяной фракции. Этиленгликоль HOCH2CH2OH, прозрачная, бесцветная, сиропообразная жидкость, т. кип. 198° С. Этиленгликоль находит широкое применение как антифриз, поскольку он полностью растворим в воде, дешев, нелетуч и сильно снижает точку замерзания водных растворов (60%-ный раствор этиленгликоля в воде замерзает при -40° С). Этиленгликоль умеренно ядовит. Глицерин HOCH2CH(OH)CH2OH, прозрачная, сладкая на вкус, бесцветная или желтоватая сиропообразная жидкость, полностью растворимая в воде, т. кип. 290° С. Легко перевариваемый и нетоксичный, глицерин находит применение как увлажняющий и текстурирующий агент в пищевых продуктах, в косметике (кремы для рук) и некоторых медицинских препаратах. В связанном виде глицерин присутствует во всех жирах и получается в больших количествах как побочный продукт при производстве мыла. Однако этого источника недостаточно для полного удовлетворения спроса на глицерин, и потому его синтезируют из продуктов переработки нефти. Одно из его главных промышленных применений - получение взрывчатого вещества нитроглицерина O2NOCH2CH(ONO2)CH2ONO2 при обработке азотной кислотой. Динамит является смесью нитроглицерина с наполнителем (см. также ГЛИЦЕРИН). Ментол, относительно летучее твердое вещество, т. пл. 43° С, является главным компонентом масла перечной мяты. Он обладает приятным запахом, и в малых количествах, будучи примешан к сигаретному дыму, каплям от кашля, жевательной резинке и другим продуктам, вызывает ощущение "холода" во рту. Его структурная формула
Существование всех живых организмов - людей, животных и растений без химии - немыслимо, потому что их самый маленький базовый строительный блок - ячейка - создается благодаря науке о химии. Клетка состоит из химических соединений различных химических элементов - всех продуктов уникальной науки.
Защита окружающей среды от загрязнений
Но до того, как наука стала известна, существовала только алхимия. В древние времена алхимики использовали его для лечения болезней, превращения металлов в золото и серебро, и как бы странно это ни звучало в наши дни - получить эликсир долголетия. Это показывает, что химия была известна людям с древности, но со временем и улучшения знаний об этом наука уже была обнаружена. Он строит живой организм, используется почти в каждой отрасли, служит для создания лекарств, и у нас не будет ни жизни, ни будущего, если бы химия не присутствовала везде.

Гераниол C10H17OH и цитронеллол C10H19OH являются главными компонентами розового масла, которому они придают приятный запах. Они используются для приготовления духов. Существуют два изомера гераниола, отличающихся только положением наиболее удаленной от ОН-группы двойной связи. Один из этих изомеров изображается формулой
Химия имеет очень важную роль, в которой мы ее наиболее легко узнаем. Химия является основой лекарств, антиоксидантов, вакцин, предназначенных для защиты от инфекционных заболеваний, таких как СПИД, корь, гепатит, столбняк, детский паралич и другие. Химия в косметике также очень важна. С ее помощью создаются различные ароматы, духи и дезодоранты, кремы, которые поддерживают нашу молодость, но не до степени эликсира для долголетия, которую хотели создать древние алхимики.
Типы химических связей
Химическая промышленность также имеет широкое распространение. Что представляли бы наши дома, если бы мы не знали химию? Они нуждаются в нем снова, потому что они находятся на базе цемента и терракоты, а также плитки из фаянса и многих других строительных материалов. И как бы наши дома выглядели без стеклянных окон без алюминиевых столярных изделий? Химия взяла на себя это, так как это также помогает в производстве керамики, фарфора, стекла, без продуктов которого не может быть современной кухни.

Цитронеллол отличается только отсутствием ближайшей к ОН двойной связи. Стерины (стеролы) - общее название твердых кристаллических спиртов стероидного ряда (см. также СТЕРОИДЫ), которые содержат ОН-группу при С-3 и алифатическую боковую цепь при С-17 в пергидроциклопентанофенантреновом скелете. Примерами стеринов являются холестерин, ситостерин и эргостерин. Стерины найдены как в растительных, так и животных тканях, где входят в состав клеточных липидных мембран. У животных холестерин служит исходным веществом для биосинтеза стероидных гормонов.
Хорошо чистить эти уютные дома? Как бы мы справлялись с их обслуживанием, если бы у нас не было различных химических препаратов, которые можно стирать, и не забывайте стиральные машины, с помощью которых мы восстанавливаем чистоту и свежесть нашей одежды. Внутренняя химия также включает краски и лаки. В противном случае, как бы выглядели наши дома, машины, одежда? Они были бы однообразными, одноцветными. Вы задали вопрос о том, что электрический ток, который мы не можем обойти, по-прежнему тесно связан с химией?
Вы представляете себе жизнь без транспортных средств? Как мы будем путешествовать на большие расстояния без массовых транспортных средств? Но они не двигаются с воздухом, не так ли? Конечно, существуют специальные виды топлива, такие как неэтилированный бензин, нафта, газ, которые необходимы для транспортировки.

Г. ФЕНОЛЫ
Фенолы - это ароматические спирты общей формулы R-OH, где группа R является остатком ароматического углеводорода (т.е. бензола, нафталина или родственного им циклического соединения). Фенолы - слабые кислоты. Практически важные фенолы. Фенол (карбоновая кислота), кристаллическое вещество, т. пл. 42° С. Обычно фенол используют в водном растворе, причем небольшое количество воды служит для "разжижения" большого количества фенола. Он имеет сильный характерный запах и представляет собой эффективный антисептик. Во время Первой мировой войны фенол широко использовался в виде разбавленного раствора для обеззараживания ран, но в современной практике его вытеснили более действенные и менее едкие дезинфицирующие средства.
Химия также используется в авиастроении - дюралюминий, легкий алюминий, химический элемент, широко используемый в разных областях. Наши родители не могут представить утреннюю чашку кофе без газеты или выходных в компании из хорошей книги, журнала. Даже если это звучит немного странно, химия тоже здесь. Принтеры не будут выпускать свои продукты без него. И как все эти журналы, брошюры, учебники разнообразны с разными цветными иллюстрациями? Мы уже знаем, что химия «имеет палец» в этой работе. Это помогает оверлей цвета, что приводит к удивительным результатам.

Среди промышленных продуктов, производимых из фенола, заслуживает упоминания пикриновая кислота - желтое красящее и взрывчатое вещество, применявшееся в больших количествах в Первой мировой войне, и различные другие красители. Креозот, используемый для предохранения и защиты древесины, содержит фенол и другие соединения, которые задерживают рост бактерий и отпугивают насекомых. Метилфенолы (крезолы) являются наиболее значимыми среди других фенольных соединений; их применяют в производстве феноло-формальдегидных смол, дезинфицирующих средств, фунгицидов, гербицидов, азокрасителей и т.д.
Нафтолы.
a-Нафтол, бесцветное или желтоватое твердое вещество с неприятным запахом, применяется в производстве красителей и синтетических душистых соединений, т. кип. 278° С. b-Нафтол, имеющий ту же брутто-формулу C10H7OH, белое блестящее твердое вещество, т. кип. 285° С; его используют как дезинфектант и в производстве красителей, медикаментов и синтетических душистых соединений.
Классификация химических реакций
Теперь никто не может этого понять, но если бы не наука, все газеты, книги были бы просто черно-белыми, равномерными, не раскрывали бы разные красители, которые естественным образом происходят естественным образом. Пищевая химия все еще присутствует в пищевой промышленности. Мы раскрываем его в кондитерской промышленности, в производстве пищевых продуктов, в окраске и стабилизации вин, алкогольных и безалкогольных напитков.
Мы уже убедились, что в нашей жизни химия - наш постоянный компаньон. Даже в самые восхитительные моменты - во время праздников - она всегда присутствует. Уникальные и уникальные, уникальные для болгар, костюмы маммеров также являются результатом химической обработки кожи, из которой они были сделаны. Как насчет волшебства десятков вин, которые обучают виноделы Трифона Зарезана! И что расскажут молодые люди о романтической атмосфере Святого Валентина, например, из-за ароматических свечей! Самое яркое использование химии - это самый христианский праздник для нас - Пасха.

Гидрохинон (1,4-дигидроксибензол) C6H4(OH)2, водорастворимое твердое вещество, т. кип. 285° С. Его применяют как фотографический проявитель для восстановления активированных солей серебра в черное мелкодисперсное металлическое серебро.
Эвгенол и тимол.
Эвгенол, бесцветная или желтоватая маслянистая жидкость, т. кип. 254° С; тимол, белое кристаллическое вещество с "ароматическим" запахом, т. кип. 233° С, и некоторые другие родственные фенолы широко распространены в эфирных маслах, например, масле гвоздики (эвгенол) и тимьяна.
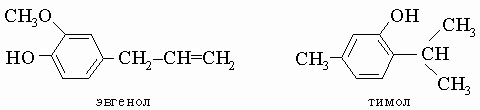
Ванилин, белое кристаллическое вещество, т. кип. 285° С; слегка растворим в воде. Он является основным душистым компонентом ванили. По этой причине его широко применяют в искусственных отдушках, причем лишь небольшой концентрации достаточно, чтобы обеспечить сильный ванильный запах. Для его синтеза имеется несколько путей.

Заметим, что ванилин содержит наравне с фенольной простую эфирную и альдегидную группы.
Д. КАРБОНОВЫЕ КИСЛОТЫ
Карбоновые кислоты имеют общую формулу R-COOH. Они являются кислотами средней силы, будучи сильнее, чем фенолы, но слабее, чем такие минеральные кислоты, как соляная, азотная или серная; как все кислоты, они имеют характерный кислый вкус. Поскольку эти кислоты высокополярны, они кипят при температурах даже более высоких, чем спирты, а простейшие кислоты (содержащие до пяти атомов углерода в цепи) растворимы в воде. Низшие кислоты - жидкие вещества, но с увеличением длины углеродной цепи повышаются и температуры плавления. Карбоновые кислоты вступают во многие важные химические реакции, а получаемые из них разнообразные продукты находят широкое применение. Многие кислоты, содержащие С=О, -OH или несколько групп -COOH, играют существенную роль в биологическом обмене веществ (см. БИОХИМИЯ). Когда кислоты реагируют с основаниями, образуются ионные соли общей формулы RCOOM, где M - ион металла. Соли жирных кислот (алифатических карбоновых кислот с длинной цепью) называются мылами. Практически важные карбоновые кислоты. Муравьиная кислота HCOOH, простейшая из карбоновых кислот. Это водорастворимая жидкость, т. кип. 100,8° С. У многих жалящих насекомых муравьиная кислота служит раздражающим компонентом яда. Уксусная кислота CH3COOH, бесцветная прозрачная жидкость, т. кип. 118° С, важный промышленный продукт, получаемый путем сбраживания сахаров (или этилового спирта) или синтетически из нефтепродуктов либо ацетилена. Уксус представляет собой разбавленный раствор уксусной кислоты, получаемой брожением, причем его кислый вкус - это вкус уксусной кислоты. Она используется в производстве ряда пластмасс, волокон, синтетических покрытий и является хорошим растворителем. Масляная кислота CH3CH2CH2COOH, т. кип. 163° С, жидкость с отвратительным запахом, обусловливающая в значительной степени неприятный запах прогорклого масла. Она находит некоторое промышленное применение как растворитель и при приготовлении бутиратов. Стеариновая кислота CH3(CH2)16COOH, воскообразное вещество, т. пл. 70° С. Она широко распространена в связанной форме как компонент жиров и используется вместе с парафином в производстве свечей для улучшения их горючих свойств, в приготовлении натриевой соли для производства мыла и кальциевой соли для детских присыпок, в производстве резины, смазок и для многих других целей. Жирные кислоты - карбоновые кислоты алифатического ряда. Алифатические кислоты с числом углеродных атомов в молекуле больше 6 называют высшими жирными кислотами (ВЖК). ВЖК могут быть природными и синтетическими. Природные ВЖК - обычные одноосновные (содержат одну карбоксильную группу в молекуле), нормального строения (неразветвленные), могут быть насыщенными или ненасыщенными. Жирные кислоты с четным числом углеродных атомов, содержащие от двух до двадцати четырех атомов углерода, можно получить из природных жиров. Компонентами этих жиров являются многочисленные ненасыщенные кислоты, наиболее обычной среди которых является олеиновая CH3-(CH2)7-CH=CH-(CH2)7-COOH, содержащая подобно стеариновой 18 атомов углерода, но имеющая одну цис-углерод-углеродную двойную связь. Как и у других ненасыщенных кислот, ее точка плавления (16° С) значительно ниже, чем у соответствующих насыщенных кислот. Адипиновая кислота HOOC(CH2)4COOH, как все кислоты с двумя и более группами -COOH, представляет собой твердое вещество. Она используется в многотоннажном производстве найлона. Молочная кислота CH3CH(OH)COOH, легко растворимое в воде вещество, плавящееся при комнатной температуре (18° С) и имеющее большое значение в биологических системах. Это она придает кислый вкус прокисшему молоку. Лимонная кислота HOOC-C(OH)(CH2COOH)2, водорастворимое твердое вещество без запаха, содержится в плодах всех цитрусовых. Водный раствор кислоты очень похож по вкусу на сок лимона, и потому лимонная кислота используется в разнообразных напитках из-за ее характерного приятного кислого привкуса. Она играет существенную роль в превращениях сахаров в организме. Винная кислота HOOCCH(OH)CH(OH)COOH, существует в трех стереоизомерных формах, называемых D-, L- и мезо-. Она присутствует в винограде и может осаждаться в виде соли в винных бочках во время брожения. Эта соль, тартрат калия-натрия, обычно известна как винный камень.
Е. АЛЬДЕГИДЫ И КЕТОНЫ
Альдегиды и кетоны имеют общие формулы R-CH=O и R-CO-R соответственно. Карбонильная группа С=О высокореакционноспособна, и поэтому альдегиды и кетоны занимают необычайно важное место в органическом синтезе многочисленных и разнообразных соединений. Некоторые члены этого класса используются в качестве ароматических добавок и душистых веществ и частично обусловливают характерные запахи некоторых растительных экстрактов и эссенций.
Практически важные альдегиды и кетоны.
Формальдегид CH2=O, газ, т. кип. -21° С, обычно используется в виде водного раствора под названием "формалин". Газообразный формальдегид полимеризуется в твердый параформ H(OCH2)nOH, из которого регенерируется при нагревании. Как и другие низкомолекулярные альдегиды, формальдегид имеет острый запах. Формалин используют для консервации биологических материалов, а формальдегид применяют в многотоннажных процессах производства синтетических волокон и пластмасс. Ацетон CH3COCH3, т. кип. 56° С, приятно пахнущая жидкость с высокой растворяющей способностью для таких материалов, как нитроцеллюлоза (используемая во взрывчатых веществах и лаках) и пластмассы. Ацетон применяется как растворитель и как разбавитель для лаков. Его также используют в синтезе более сложных органических соединений. Акролеин CH2=CH-CH=O, т. кип. 56° С; его пары обладают раздражающим действием на слизистую. Он образуется при пиролизе ("перегреве") жиров.
Бензохинон.
Желтое легко возгоняющееся твердое вещество, бензохинон является простейшим членом класса соединений, известных как "хиноны", которые содержат подобную циклическую систему. Некоторые хиноны представляют собой важные красители, другие являются пигментами растений и насекомых.

Камфора (камфара) представляет собой твердый летучий кетон с характерным приятным запахом. Из камфарного дерева получают L-форму, а D,L-форму производят в промышленных масштабах путем синтеза из других природных продуктов.
Ж. ПРОСТЫЕ ЭФИРЫ
Простые эфиры имеют общую структуру R-O-R", в которой R и R" представляют собой углеводородные группы. Низшие члены ряда являются жидкостями, полярность их молекул низка (как и в случае углеводородов и органических галогенидов).
Практически важные простые эфиры.
Диэтиловый эфир C2H5OC2H5, обычно называемый просто "эфир", - прозрачная, бесцветная жидкость с характерным запахом, кипящая при 35° С. Эфир используют как анестетик для наркоза, как растворитель для различных органических веществ и для химической чистки одежды. Этиленоксид, т. кип. 11° С, высокореакционноспособный газ, применяемый в ряде органических синтезов, в том числе при получении этиленгликоля (первичный компонент большинства антифризов) и в производстве важного класса растворителей, известных под общим названием "целлозольвов" (R-O-CH2CH2-OH).
З. СЛОЖНЫЕ ЭФИРЫ
Сложные эфиры R-COOR" рассматриваются как производные карбоновых кислот, поскольку их можно получить отщеплением молекулы воды от кислоты и спирта: R-COOH + R"-OH -> R-COOR" + H2O Летучие эфиры - жидкости с приятным фруктовым ароматом, прекрасные растворители для органических веществ. Некоторые эфиры обусловливают аромат душистых растений.
Практически важные сложные эфиры.
Этилацетат CH3COOC2H5, т. кип. 77° С, находит свое главное применение как растворитель. Он образуется в реакции между этиловым спиртом и уксусной кислотой в присутствии катализатора. Амилацетат CH3COOCH2CH2CH2CH2CH3, т. кип. 148° С, иногда называют "банановым маслом" (которое он напоминает по запаху). Он образуется в реакции между амиловым спиртом (часто - сивушным маслом) и уксусной кислотой в присутствии катализатора. Амилацетат широко применяется как растворитель для лаков, поскольку он испаряется медленнее, чем этилацетат.
Фруктовые эфиры.
Характер многих фруктовых запахов, таких, как запахи малины, вишни, винограда и рома, отчасти обусловлен летучими эфирами, например этиловым и изоамиловым эфирами муравьиной, уксусной, масляной и валериановой кислот. Имеющиеся в продаже эссенции, имитирующие эти запахи, содержат подобные эфиры. Винилацетат CH2=CHOOCCH3, образуется при взаимодействии уксусной кислоты с ацетиленом в присутствии катализатора. Это важный мономер для приготовления поливинилацетатных смол, клеев и красок. Среди других сложных эфиров большое практическое значение имеют жиры, которые являются триэфирами глицерина и жирных кислот, а также воски - эфиры высокомолекулярных спиртов и высших жирных кислот.
И. АМИНЫ
Аминами называются производные аммиака NH3, получаемые путем замещения в нем атома H на органическую группу R; в зависимости от числа замещенных атомов водорода они могут быть первичными (RNH2), вторичными (R2NH) и третичными (R3N). (Присоединение четвертой группы R дает ряд ионных солей R4N+X-, напоминающих по структуре соли аммония, которые в противоположность аминам являются нелетучими твердыми веществами без запаха или с очень слабым запахом.) Амины представляют собой самую важную группу органических оснований: они имеют большое биологическое значение и применяются для получения разнообразных производных, включая красители и медицинские препараты.
Практически важные амины.
Триметиламин (CH3)3N, подобно другим низкомолекулярным аминам, является газом с аммиачным, или "рыбным" запахом. Он образуется при разложении рыбы. Его получают взаимодействием метилового спирта или диметилового эфира с аммиаком; используют для производства бактерицидов, флотореагентов, кормовых добавок. Анилин C6H5NH2, т. кип. 184° С, бесцветная маслянистая жидкость, которая быстро становится бурой при контакте с воздухом и светом. Является исходным материалом для получения ряда анилиновых красителей, лекарственных средств (сульфамидных препаратов, ацетанилида и др.), взрывчатых веществ, анилино-формальдегидных смол, антиоксидантов, фотоматериалов и т.д. Адреналин, амфетамин (бензедрин) и эфедрин. Адреналин - гормон, выделяемый надпочечниками, который вызывает сужение капиллярных сосудов и тем способствует повышению давления крови. Секреция этого гормона увеличивается в моменты стресса, помогая организму адекватно реагировать на опасность. Амфетамин (бензедрин, синтетический препарат) и эфедрин имеют сходное действие.

Аминокислоты содержат как амино-, так и кислотную карбоксильную группу. Аминокислоты играют большую роль в химии живых систем. Из них особенно важны a-аминокислоты общей структуры R-CH(NH2)-COOH, которые являются строительными блоками белков.
К. ДРУГИЕ ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
Азотсодержащие группы.
Кроме аминов, азот содержат различные другие функциональные группы. Амиды имеют общую структуру RC(O)NR"R ", где R" и R " - органическая группа или H; почти все они являются твердыми веществами. Нитросоединения R-NO2 представляют собой важные промежуточные соединения в органическом синтезе и взрывчатые вещества - тринитротолуол, тринитрофенол (пикриновая кислота), нитроглицерин. В нитрилах азот связан с углеродом тройной связью R-CєN; азосоединения содержат группу -N=N-, которая придает окраску многим синтетическим красителям.
Соединения серы.
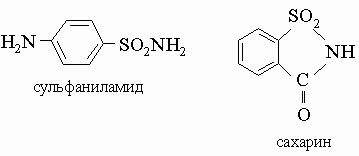
Наиболее важными типами сернистых соединений являются меркаптаны (тиолы) R-SH и сульфокислоты R-SO3H, представляющие собой сильные кислоты. Низшие меркаптаны - газы или жидкости с неприятным запахом. Метилмеркаптан CH3SH - газ, используемый для придания легко распознаваемого неприятного запаха топливному газу, который сам по себе почти лишен запаха, с целью обнаружения утечек газа. Бутилмеркаптан CH3CH2CH2CH2SH - жидкость, обнаруженная в пахучих железах скунса. Соли сульфокислот с длинной углеводородной цепью используют как моющие средства; сульфаниламидные лекарственные препараты и сахарин - также производные сульфокислот.
Другая классификация.
Чтобы подчеркнуть общий источник, функции или сложные структурные особенности, органические соединения часто классифицируют по другим признакам, чем их функциональные группы.
См. также
Химическое соединение (hs) Химическое соединение (сложное вещество ) - сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов. Некоторые простые вещества также могут рассматриваться как химические соединения, если их молекулы состоят из атомов, соединённых ковалентной связью (например, азот ~N_2, кислород ~O_2 и др.). Состав химического соединения записывается в виде химических формул, а строение часто изображается структурными формулами.
Химический элемент
Химический элемент - это множество атомов с одинаковым зарядом ядра, числом протонов, совпадающим с порядковым или атомным номером в таблице Менделеева. Каждый химический элемент имеет свои название и символ, которые приводятся в Периодической системе элементов Дмитрия Ивановича Менделеева . Формой существования химических элементов в свободном виде являются простые вещества (одноэлементные)
Химические соединения и химические элементы
Химические соединения - химически индивидуальное вещество, состоящее из атомов различных элементов. Важный признак химического соединения - однородность и постоянство состава - соединение химических элементов.
Неорганических 100 000 соединений
Органических 3 000 000 соединений
Свойства химических соединений - Физические и химические свойства химических соединений отличаются от свойств веществ, из которых они получены. Химические соединения разделяются на неорганические и органические. Известно более 100 тыс. неорганических и более 3 млн органических соединений. Каждое химическое соединение, которое описано в литературе, имеет уникальный цифровой идентификатор, число CAS.
Органические химические соединения - Органическая химия, естественнонаучная дисциплина, предметом изучения которой являются соединения углерода с др. элементами, называемые органическими соединениями, а также законы превращения этих веществ. Углерод образует соединения с большинством элементов и обладает наиболее выраженной способностью по сравнению с др. элементами к образованию молекул цепного и циклического строения. Скелет таких молекул может состоять из практически неограниченного числа атомов углерода, непосредственно соединённых друг с другом, или включать наряду с углеродом атомы др. элементов. Для соединений углерода наиболее характерно явление изомерии, т. е. существование веществ, одинаковых по составу и молярной массе, но различающихся последовательностью сцепления атомов или расположением их в пространстве и вследствие этого по химическими и физическим свойствам. В результате этих особенностей число органических веществ чрезвычайно велико, к 70-м гг. 20 в. известно более 3 млн., в то время как соединений всех остальных элементов - немногим более 100 тыс.
Органические соединения способны к сложным и многообразным превращениям, существенно отличным от превращений неорганических веществ, и играют основную роль в построении и жизнедеятельности растительных и животных организмов. К органическим соединениям относятся углеводы и белки, с которыми связан обмен веществ; гормоны, регулирующие этот обмен; нуклеиновые кислоты, являющиеся материальными носителями наследственных признаков организма; витамины и др. О. х. представляет собой т. о. как бы своеобразный «мост» между науками, изучающими неживую материю и высшую форму существования материи - жизнь. Многие явления и закономерности химической науки, например изомерия, впервые были открыты при изучении именно органических соединений.
Химические соединения металлов, химическое соединение водорода с металлом, химическое соединение железа с углеродом
химическая реакция соединения
Реакции химические - превращение одних веществ в другие, отличные от исходных по химическому составу или строению. Общее число атомов каждого данного элемента, а также сами химические элементы, составляющие вещества, остаются в Р. х. неизмененными; этим Р. х. отличаются от ядерных реакций. Р. х. осуществляются при взаимодействии веществ между собой или при внешних воздействиях на них температуры, давления, электрического и магнитного полей и т.п. В ходе Р. х. одни вещества (реагенты) превращаются в другие (продукты реакции), что записывается в виде уравнений химических. Реагенты и продукты реакции часто носят общее название реактанты. Каждая Р. х. характеризуется стехиометрическим соотношением реактантов и скоростью химической реакции. Совокупность отдельных стадий Р. х., установленная экспериментально или предложенная на основе теоретических представлений, называется механизмом реакции.
Любая Р. х. обратима, хотя скорости прямой и обратной реакций могут при этом существенно отличаться. Когда скорости прямой и обратной реакций равны, система находится в равновесии химическом. В положении равновесия или вблизи него поведение системы описывается законами и соотношениями термодинамики химической. В целом изучение механизмов и скоростей как обратимых, так и практически необратимых Р. х. составляет предмет химической кинетики, а при учёте также и физических процессов в системе (диффузия, теплопередача и др.) - предмет макрокинетики. При изучении Р. х. на молекулярном уровне используют представления о взаимодействии атомов и молекул при их столкновениях друг с другом, с электронами и др. частицами, о превращениях молекул при поглощении и испускании фотонов и т.п. Этот подход базируется, как правило, на квантовой теории и связан в основном с изучением элементарного акта Р. х., т. е. отдельного процесса столкновения молекул реактантов. Квантовомеханическое описание элементарного акта базируется на одном из двух подходов. При временном подходе элементарный акт рассматривается как процесс рассеяния подсистем (атомов, молекул, ионов) при их столкновении. Согласно стационарному подходу, исследуется движение конфигурационной точки (изображающей ядерную конфигурацию всей системы реактантов) по потенциальной поверхности, определяемой взаимодействием подсистем реактантов, в частности ядер молекул в усреднённом поле электронов. Начало стационарному подходу было положено введением представления об активированном комплексе. При сравнительном рассмотрении реакций, особенно в органической химии, пользуются обычно представлениями о наиболее вероятных механизмах реакций и об активности реагентов в определённых классах реакций, такими как реакционная способность, ориентации правила, нуклеофильные и электрофильные реагенты,принцип сохранения орбитальной симметрии (см. Симметрия в химии) и т.п.
Р. х. существенно зависят как от природы реактантов, так и от внешних условий реакции. Многие Р. х. возможны только под воздействием внешних источников энергии: тепловой, электромагнитной (фотохимические реакции), электрической (электрохимические реакции). При этом сама Р. х. может служить источником энергии. Количественное экспериментальное изучение Р. х. привело к установлению ряда основных законов химии, отражающих как стехиометрию, так и энергетику реакций. К таким законам относятся постоянства состава закон, Гесса закон и др. Классификация Р. х. проводится по различным признакам и различается в зависимости от того, в какой области химии они исследуются. Термодинамическая классификация использует в качестве таких признаков: энергетику реакций (экзотермические, т. е. идущие с выделением тепла, и эндотермические, т. е. идущие с поглощением тепла); количество фаз реактантов (гомогенные и гетерогенные реакции). Различают Р. х., идущие в объёме, на поверхности раздела фаз и т.д. Кинетическая классификация выделяет следующие признаки: скорость прямой и обратной реакций (обратимые и необратимые реакции); число взаимосвязанных реакций в системе (простая реакция, т. е. только одна, практически необратимая реакция, и сложная реакция, которую можно подразделить на несколько простых); молекулярность реакции (число молекул, одновременным взаимодействием между которыми осуществляется элементарный акт химического превращения); порядок реакции по каждому реагенту и в целом (см. Кинетика химическая). Сложные Р. х. по форме связи простых реакций подразделяются на параллельные, последовательные, сопряжённые, обратимые и т.д. В отдельную группу выделяется обширный класс каталитических реакций (см. Катализ). В зависимости от того, какие частицы участвуют в элементарном акте, реакции подразделяются на молекулярные, ионные, фотохимические и т.д., а также радикальные или цепные реакции. Детальное подразделение реакций проводится и по их механизму.
В неорганической химии широко используется классификация Р. х. по типам участвующих в них соединений и по характеру их взаимодействия: реакции образования и разложения, гидролиза, нейтрализации реакции, реакции окисления-восстановления. Большую группу Р. х. составляют различные реакции комплексообразования.
Органические реакции - две группы: гетеролитические, при которых разрыв связи в молекуле происходит несимметрично и электроны остаются спаренными, и гомолитичные, в которых происходит симметричный разрыв связи, в результате чего образуются радикалы. В зависимости от типа атакующего реагента гетеролитические реакции могут быть нуклеофильными (обозначаются символом N)и электрофильными (символ Е). Основные три класса органических реакций включают замещения (обозначаются символом S с индексами N или Е), присоединения (символ А) и отщепления (элиминирования, символ Е). Каждая из этих реакций в зависимости от механизма может осуществляться как нуклеофильный, электрофильный или радикальный процесс. Особый класс реакций составляют реакции циклоприсосдинения. С учётом молекулярности лимитирующей стадии различают мономолекулярные (например, SE 1) и бимолекулярные (например, SE 2) реакции. Помимо указанных механизмов, присоединения и замещения реакции могут происходить в результате окислительно-восстановительного взаимодействия реагентов. Многие органические реакции включают ряд последовательных стадий, в том числе обратимых. Общая обратимость характерна для таких, например, реакций, как реакции металлирования и ароматического сульфирования. Возможны реакции, в которых промежуточные соединения вступают в параллельные реакции, что приводит к образованию смеси продуктов. Многочисленные превращения органических молекул включают процессы, происходящие без изменения состава, но приводящие к изменению химического строения (структуры) соединения, например различного типа изомеризации, молекулярные перегруппировки и таутомерные превращения (см. Органическая химия).
Понятие Р. х. является в известной степени условным. Так, к числу Р. х. обычно не относят образование ассоциатов в растворах, электронные возбуждения молекул (даже при существенном изменении равновесной геометрической конфигурации) и ряд др. процессов.
Закон постоянства состава и закону кратных отношений
В большинстве случаев химические соединения подчиняется закону постоянства состава и закону кратных отношений. Однако известны довольно многочисленные соединения переменного состава.
Химические соединения получают в результате химических реакций. Образование химических соединений сопровождается выделением (экзотермическая реакция) или поглощением (Эндотермическая реакция) энергии. Физические и химические свойства химических соединений отличаются от свойств веществ, из которых они получены. Химические соединения разделяются на неорганические и органические. Известно более 100 тыс. неорганических и более 3 млн органических соединений. Каждое химическое соединение, которое описано в литературе, имеет уникальный цифровой идентификатор, число CAS.
Сложные вещества:
Оксиды (~H_2O, ~CaO, ~CO_2, ~P_2O_5 и др.)
- основания (~NaOH, ~Ca(OH)_2, ~Al(OH)_3, ~Fe(OH)_3 и др.)
- кислоты (~HCl, ~HNO_3, ~H_2SO_4, ~H_3PO_4 и др.)
- соли (~NaCl, ~KNO_3, ~CuSO_4, ~Ca_3(PO_4)_2 и др.)
Простые вещества - вещества, состоящие исключительно из атомов одного химического элемента (в отличие от сложных веществ). Являются формой существования химических элементов в свободном виде], или, иначе говоря, элементы, не связанные химически ни с каким другим элементом, образуют простые вещества. Известно свыше 400 разновидностей простых веществ.
В зависимости от типа химической связи между атомами простые вещества могут быть металлами ( , , , и другие) и неметаллами (H2, N2, Br2, Si и другие).
Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные ( , ) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Аллотропные модификации
Один и тот же химический элемент зачастую может образовывать несколько типов простых веществ (аллотропия), называемых аллотропными модификациями. Явление аллотропии может быть обусловлено либо различным составом молекул данного элемента (аллотропия состава), либо различным строением молекул и способом размещения молекул (атомов) в кристаллах (аллотропия формы). Способность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов.
Различные аллотропные модификации могут переходить друг в друга. Для данного химического элемента его аллотропные модификации всегда различаются по физическим свойствам и химической активности (например, озон активнее кислорода, температура плавления алмаза больше, чем фуллерена).
Агрегатное состояние
При нормальных условиях соответствующие простые вещества для 11 элементов являются газами ( , , , , , , , , , , ), для 2 - жидкостями (Br, Hg), для остальных элементов - твёрдыми телами.
При комнатной температуре (либо близкой к ней) 5 металлов находятся в жидком либо полужидком состоянии, так как их температура плавления близка к комнатной:
Отношение понятий
Понятия атом, химический элемент и простое вещество не следует смешивать. Атом - конкретное понятие, так как атомы существуют реально. Химический элемент - это собирательное, абстрактное понятие; в природе химический элемент существует в виде свободных или химически связанных атомов, то есть простых и сложных веществ.
Также нужно различать свойства (характеристики) простого вещества (совокупности частиц) и свойства (характеристики) химического элемента (изолированного атома определенного вида)
Характеристики химического элемента
атомный номер
относительная атомная масса
изотопный состав
распространённость в природе
положение в периодической системе
строение атома
энергия ионизации
сродство к электрону
электроотрицательность
степени окисления
валентность
аллотропные модификации
химический знак
и другие
Характеристики простого вещества
окраска
запах
электропроводность
теплопроводность
растворимость
твёрдость
температура кипения
температура плавления
вязкость
молярная масса
оптические свойства
магнитные свойства
химическая формула
и другие
Названия химических элементов и соответствующих простых веществ совпадают в большинстве случаев. Однако существуют и исключения. Например, названия аллотропных модификаций кислорода - кислород (дикислород O2) и озон; углерода - алмаз, графит, карбин, фуллерен.
Каждый химический элемент имеет свое условное обозначение - химический знак (символ). В ряде случаев химический знак может также выражать состав простого вещества (Zn, B, C, Ar). Однако, например, символ O обозначает только химический элемент, простое вещество кислород имеет формулу O2.
Органические вещества
Органические вещества, органические соединения - класс соединений, в состав которых входит углерод (за исключением карбидов, угольной кислоты, карбонатов, оксидов углерода и цианидов).
Название органические соединения появилось на ранней стадии развития химии во время господства виталистических воззрений, продолжавших традицию Аристотеля и Плиния Старшего о разделении мира на живое и неживое. Вещества при этом разделялись на минеральные - принадлежащие царству минералов, и органические - принадлежащие царствам животных и растений. Считалось, что для синтеза органических веществ необходима особая «жизненная сила» (лат. vis vitalis), присущая только живому, и поэтому синтез органических веществ из неорганических невозможен. Это представление было опровергнуто Фридрихом Вёлером в 1828 году путём синтеза «органической» мочевины из «минерального» цианата аммония, однако деление веществ на органические и неорганические сохранилось в химической терминологии и по сей день.
Основные классы органических соединений биологического происхождения - белки, липиды, углеводы, нуклеиновые кислоты - содержат, помимо углерода, преимущественно водород, азот, кислород, серу и фосфор. Именно поэтому «классические» органические соединения содержат прежде всего водород, кислород, азот и серу - несмотря на то, что элементами, составляющими органические соединения, помимо углерода могут быть практически любые элементы.
Соединения углерода с другими элементами составляют особый класс органических соединений - элементоорганические соединения. Металлоорганические соединения содержат связь металл-углерод и составляют обширный подкласс элементоорганических соединений.
Количество известных органических соединений давно перевалило за 10 млн. Таким образом, органические соединения - самый обширный класс химических соединений. Многообразие органических соединений связано с уникальным свойством углерода образовывать цепочки из атомов углерода, что в свою очередь обусловлено высокой стабильностью (то есть энергией) углерод-углеродной связи. Связь углерод-углерод может быть как одинарной, так и кратной - двойной, тройной. При увеличении кратности углерод-углеродной связи возрастает её энергия, то есть стабильность, а длина уменьшается. Высокая валентность углерода - 4, а также возможность образовывать кратные связи, позволяет образовывать структуры различной размерности (линейные, плоские, объёмные).
Существует несколько важных свойств, которые выделяют органические соединения в отдельный, ни на что не похожий класс химических соединений.
1. Различная топология образования связей между атомами, образующими органические соединения (прежде всего, атомами углерода), приводит к появлению изомеров - соединений, имеющих один и тот же состав и молекулярную массу, но обладающих различными физико-химическими свойствами. Данное явление носит название изомерии.
2. Явление гомологии - существование рядов органических соединений, в которых формула любых двух соседей ряда (гомологов) отличается на одну и ту же группу (чаще всего CH2). Целый ряд физико-химических свойств в первом приближении изменяется симбатно по ходу гомологического ряда. Это важное свойство используется в материаловедении при поиске веществ с заранее заданными свойствами.
Номенклатура органических соединений
Органическая номенклатура - представляет систему классификации и наименований органических веществ. В настоящее время распространена номенклатура ИЮПАК.
Классификация органических соединений построена на важном принципе, согласно которому физические и химические свойства органического соединения в первом приближении определяются двумя основными критериями - строением углеродного скелета соединения и его функциональными группами.
В зависимости от природы углеродного скелета органические соединения можно разделить на ациклические и циклические. Среди ациклических соединений различают предельные и непредельные. Циклические соединения разделяются на карбоциклические (алициклические и ароматические) и гетероциклические.
Органические соединения
Углеводороды
+ Ациклические соединения
# Предельные углеводороды (алканы)
# Непредельные углеводороды
* Алкены
* Алкины
* Алкадиены (диеновые углеводороды)
+ Циклические углеводороды
# Карбоциклические соединения
* Алициклические соединения
* Ароматические соединения
# Гетероциклические соединения
o Другие классы органических соединений
+ Спирты, Фенолы
+ Альдегиды, Кетоны
+ Карбоновые кислоты
+ Сложные эфиры
+ Жиры
+ Углеводы
+ Амины
+ Аминокислоты
+ Белки
+ Нуклеиновые кислоты
Алифатические соединения
Алифатические соединения - органические вещества, не содержащие в структуре ароматических систем.
Углеводороды - Алканы - Алкены - Диены или Алкадиены - Алкины - Галогенуглеводороды - Спирты - Меркаптаны - Простые эфиры - Альдегиды - Кетоны - Карбоновые кислоты - Сложные эфиры - Углеводы или сахара - Нафтены - Амиды - Амины - Липиды - Нитрилы
Ароматические соединения
Ароматические соединения, или арены, - органические вещества, в структуру которых входит одна (или более) ароматическая циклическая система (см. Ароматизация)
Бензол-Толуол-Ксилол-Анилин-Фенол-Ацетофенон-Бензонитрил- Галогенарены-Нафталин-Антрацен-Фенантрен-Бензпирен-Коронен-Азулен-Бифенил-Ионол.
Гетероциклические соединения
Гетероциклические соединения - вещества, в молекулярной структуре которых присутствует хотя бы один цикл с одним (или несколькими) гетероатомом
Пиррол-Тиофен-Фуран-Пиридин
Полимеры
Полимеры представляют собой особый вид веществ, также известный как высокомолекулярные соединения. В их структуру обычно входят многочисленные сегменты меньшего размера. Эти сегменты могут быть идентичны, и тогда речь идет о гомополимере. Полимеры относятся к макромолекулам - классу веществ, состоящих из молекул очень большого размера. Полимеры могут быть органическими (полиэтилен, полипропилен, плексиглас и т. д.) или неорганическими (силикон); синтетическими (поливинилхлорид) или природными (целлюлоза, крахмал).
Структурный анализ органических веществ
В настоящее время существует несколько методов характеристики органических соединений. Кристаллография (рентгеноструктурный анализ) - наиболее точный метод, требующий, однако, наличия высококачественного кристалла достаточного размера для получения высокого разрешения. Поэтому пока этот метод не используется слишком часто.
Элементный анализ - деструктивный метод, использующийся для количественного определения содержания элементов в молекуле вещества.
Инфракрасная спектроскопия (ИК): используется главным образом для доказательства наличия (или отсутствия) определенных функциональных групп.
Масс-спектрометрия: используется для определения молекулярных масс веществ и способов их фрагментации.
Спектроскопия ядерного магнитного резонанса ЯМР.
Ультрафиолетовая спектроскопия (УФ): используется для определения степени сопряжения в системе
Аналитическая химия.
Сферы
Сферы = оболочки или окружения связанные определенной тематикой. Как правило сферы охватывают
заселённая живыми организмами, находящаяся под их воздействием и занятая продуктами их жизнедеятельности; «пленка жизни»; глобальная экосистема Земли.
Биосфера
- Ноосфера
- Техносфера
- Атмосфера
- Гидросфера
- Основные законы эволюции живого вещества в биосфере
- Ноосфера
- БИОС-3
- Биосфера 2
- Среда обитания
- Биотическая регуляция окружающей среды